دروس خصوصية مع الأستاذ بن أحمد
لكل مستويات الطور الثانوي في مادة العلوم الفيزيائية
إقرأ المزيدالمستوى: undefined undefined
الحصة: undefined
المجال: undefined
الوحدة: undefined
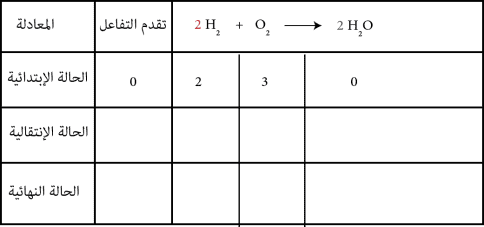
هو جدول يبين تغيرات كمية المادة للمتفاعلات و النواتج في التفاعل الكيميائي
مثال: لدينا تفاعل غاز ثنائي الأكسجين كمية مادته و غاز ثنائي الهيدروجين كمية مادته معادلته:
المستوى: undefined undefined
الحصة: undefined
المجال: undefined
الوحدة: undefined
في سطر الحالة الإبتدائية أكتب كمية المادة الإبتدائية للمتفاعلات و صفر للنواتج و تقدم التفاعل
في سطر الحالة الإنتقالية أكتب كمية المادة المتفاعلات ناقص العدد الستوكيومتري الخاص بها في x أما النواتج فالعدد الستوكيومتري في x
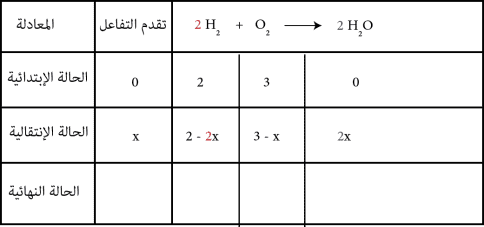
في الحالة النهائية أعد كتابة نفس الشيء في الحالة الإنتقالية لكن بدل x ب
المستوى: undefined undefined
الحصة: undefined
المجال: undefined
الوحدة: undefined
أكتب جدول التقدم للتفاعل التالي:
حيث كمية مادة ثنائي الكلور تساوي و كمية مادة ثنائي الهيدروجين
يتفاعل من النحاس مع نثائي الأكسجين ليعطي أكسيد النحاس
نمزج من الألمنيوم مع من محلول ثنائي الكلور ذي التركيز المولي لينتج كلوريد الألمنيوم
معطيات:
المستوى: undefined undefined
الحصة: undefined
المجال: undefined
الوحدة: undefined
تسجيل
دروس
تمارين
دروس خصوصية